
亞硫酸鈉循環脫硫法使用穩定的耐酸泵有哪些?
時間: 2019-04-26 13:40
瀏覽次數:
什么是亞硫酸?化學式Na2SO3,常見的亞硫酸鹽,白色、單斜晶體或粉末。對眼睛、皮膚、粘膜有刺激作用,可污染水源。受高熱分解產生有毒的硫化物煙氣。工業上主要用于制亞硫酸纖
什么是亞硫酸?化學式Na2SO3,常見的亞硫酸鹽,白色、單斜晶體或粉末。對眼睛、皮膚、粘膜有刺激作用,可污染水源。受高熱分解產生有毒的硫化物煙氣。工業上主要用于制亞硫酸纖維素酯、硫代硫酸鈉、有機化學藥品、漂白織物等, 還用作還原劑、防腐劑、去氯劑等。
目前使用穩定的亞硫酸耐酸泵有:LHF襯氟離心泵,LHC抗干磨襯氟磁力泵,LMU耐腐耐磨脫硫泵,LFK襯氟料漿泵等,能耐強酸(包括氫氟酸、發煙硫酸、硝酸、氟硅酸等)、強堿、氯離子、有機溶劑、強氧化劑腐蝕等,此泵的特點:泵具有耐腐、耐磨、耐高溫、不老化、機械強度高、運轉平穩、結構先進合理、密封性能嚴格可靠、拆卸檢修方便、使用壽命長等優點。
亞硫酸鈉在空氣中易風化并氧化為硫酸鈉。在150℃時失去結晶水。再熱則熔化為硫化鈉與硫酸鈉的混合物。無水物的密度2.633。比水合物氧化緩慢得多,在干燥空氣中無變化。受熱分解而生成硫化鈉和硫酸鈉,與強酸接觸分解成相應的鹽類而放出二氧化硫。亞硫酸鈉還原性極強,可以還原銅離子為亞銅離子(亞硫酸根可以和亞銅離子生成配合物而穩定),也可以還原磷鎢酸等弱氧化劑。亞硫酸鈉及其氫鹽在實驗室可以用于清除醚類物質的過氧化物(加入少量水,微熱攪拌反應后分液,醚層用生石灰干燥,用于一些要求不高的反應)。可與硫化氫歸中。
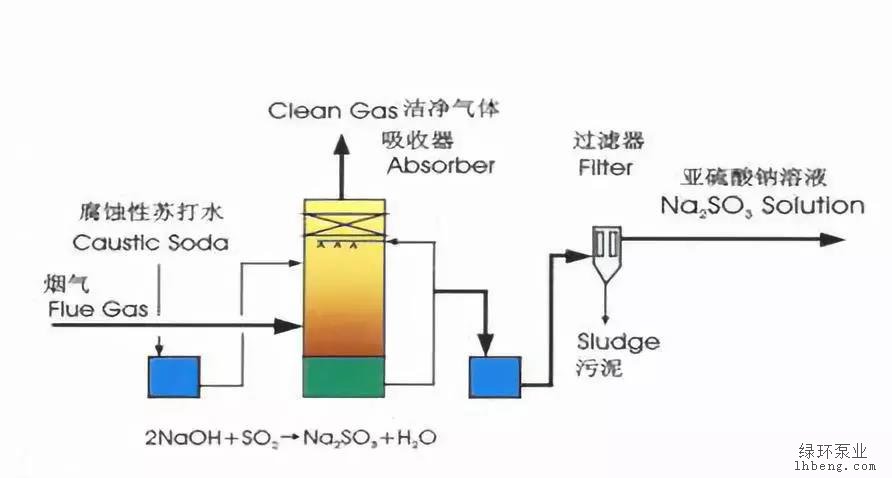
亞硫酸鈉法煙氣脫硫,是采用亞硫酸鈉水溶液吸收SO?的煙氣脫硫工藝。Na?SO?吸收SO?生成NaHSO?。將含有Na?SO?- NaHSO?的吸收液進行加熱再生得到增濃的SO?,再生的吸收劑返回吸收器回路中,再生工序得到的SO?中含水蒸氣較多,可用冷凝法去除,必要時可經濃硫酸干燥塔干燥,回收的SO?可以生產液態SO?、液態SO?、硫酸或元素硫,視市場和成本而定。該脫硫工藝包括煙氣預處理、SO?吸收、吸收劑再生、SO?回收和產品純化等工序。煙氣預處理去除飛灰和氯化物,SO?吸收在分餾塔式吸收器內進行,脫硫率達90%以上。在吸收塔中部分Na?SO?氧化為硫酸鈉,需定時補充鈉(以碳酸鈉或氫氧化鈉形式),以10水合物存在的硫酸鈉(芒硝)可通過真空結晶作用不斷地從再生的吸收液中除去。該工藝脫硫率高,操作管理方便,回收的SO?濃度高,用途較廣。適合處理大氣量的煙氣。
裝置:脫硫工藝包括煙氣預處理、SO2吸收、吸收劑再生、SO2回收和產品純化等工序。
脫硫原理:該工藝以亞硫酸鈉為吸收劑,在低溫條件下吸收煙氣中二氧化硫,生成亞硫酸氫鈉。飽和溶液通過加熱、分解重新產生 SO2可用于制硫酸或硫磺。由于水的蒸發而使亞硫酸鈉結晶,亞硫酸鈉結晶經溶解后再用作吸收劑循環使用,故也稱之為“亞硫酸鈉循環法”。
優點: 脫硫率高;操作管理方便,適應強;吸收塔壓力損失小;回收的SO2濃度高,用途較廣;吸收劑可循環使用。
缺點:吸收劑的消耗量大;氧化副產品 Na2SO4的分離困難,結晶水合物中含有亞硫酸鈉造成 2 次污染;投資運行費用高。
適用范圍:適合處理大氣量的煙氣。
亞硫酸鈉在空氣中易風化并氧化為硫酸鈉。在150℃時失去結晶水。再熱則熔化為硫化鈉與硫酸鈉的混合物。無水物的密度2.633。比水合物氧化緩慢得多,在干燥空氣中無變化。受熱分解而生成硫化鈉和硫酸鈉,與強酸接觸分解成相應的鹽類而放出二氧化硫。亞硫酸鈉還原性極強,可以還原銅離子為亞銅離子(亞硫酸根可以和亞銅離子生成配合物而穩定),也可以還原磷鎢酸等弱氧化劑。亞硫酸鈉及其氫鹽在實驗室可以用于清除醚類物質的過氧化物(加入少量水,微熱攪拌反應后分液,醚層用生石灰干燥,用于一些要求不高的反應)。可與硫化氫歸中。

說點什么吧
- 全部評論(0)
meirunsh@126.com 評論 LHC型抗干磨襯氟磁力:襯氟磁力泵可耐多高溫度? 管理員回復: 標準配置的可以耐溫
老鳳 評論 LHF襯氟離心泵:這種襯氟泵是一種比較老的泵了,用戶反應性價比高,輸送含顆
老鳳 評論 LZX不銹鋼強力自吸泵:這自吸泵能吸到幾米高?6米可以嗎?
36001522 評論 CQB-F型氟塑料磁力泵:好產品,厲害了
清風 評論 IHL不銹鋼離心泵:我們現場用的綠環泵質量不錯,用了幾年了。
新神光化工 評論 關于綠環全新一代L:這種磁力泵不錯,綠環歷時三年研發,果然不同凡響。 管理員回
老鳳 評論 深度了解耐腐蝕泵使:電機過載的原因我覺得大部分還是由于泵在低揚程狀態下運行。
老鳳 評論 LHC型抗干磨襯氟磁力:綠環泵業的這種抗干磨磁力泵結構做的很好。值得推廣使用。我
 5687879@163.com 評論 不銹鋼化工離心泵可:這種集裝式機封相當不錯,結構為靜止式機封,可以耐很多顆粒
5687879@163.com 評論 不銹鋼化工離心泵可:這種集裝式機封相當不錯,結構為靜止式機封,可以耐很多顆粒 5687879@163.com 評論 不銹鋼化工離心泵可:這種集裝式機封相當不錯,結構為靜止式機封,可以耐很多顆粒
5687879@163.com 評論 不銹鋼化工離心泵可:這種集裝式機封相當不錯,結構為靜止式機封,可以耐很多顆粒 5687879@163.com 評論 不銹鋼化工離心泵可:這種集裝式機封相當不錯,結構為靜止式機封,可以耐很多顆粒
5687879@163.com 評論 不銹鋼化工離心泵可:這種集裝式機封相當不錯,結構為靜止式機封,可以耐很多顆粒 44553452@126.com 評論 淺談襯氟泵和耐酸泵:綠環的襯氟泵最大可以做到多大?
44553452@126.com 評論 淺談襯氟泵和耐酸泵:綠環的襯氟泵最大可以做到多大? 45788892@163.com 評論 氟合金泵和氟塑料泵:一直以為氟合金泵是一種金屬泵,原來是這樣的?
45788892@163.com 評論 氟合金泵和氟塑料泵:一直以為氟合金泵是一種金屬泵,原來是這樣的? 老鳳 評論 淺談脫硫循環泵應該:1500噸的脫硫泵,你們能做嗎?鈉堿法脫硫工藝。我是做環保工程
老鳳 評論 淺談脫硫循環泵應該:1500噸的脫硫泵,你們能做嗎?鈉堿法脫硫工藝。我是做環保工程 42756855@qq.com 評論 耐腐蝕襯氟球閥安裝:襯氟球閥最大能做DN多少的?有沒有相關業績?
42756855@qq.com 評論 耐腐蝕襯氟球閥安裝:襯氟球閥最大能做DN多少的?有沒有相關業績? 12354@163.com 評論 耐腐蝕離心泵配虹吸:你們很專業,幫我省了很多錢,而且效果還不錯。
12354@163.com 評論 耐腐蝕離心泵配虹吸:你們很專業,幫我省了很多錢,而且效果還不錯。 大鳳 評論 淺談襯氟泵和耐酸泵:你們做的襯氟泵耐高溫多少度?
大鳳 評論 淺談襯氟泵和耐酸泵:你們做的襯氟泵耐高溫多少度? 大鳳 評論 襯氟離心泵拆卸遇到:襯氟離心泵有沒有其他連接方式?我覺的這種錐度連接不太好
大鳳 評論 襯氟離心泵拆卸遇到:襯氟離心泵有沒有其他連接方式?我覺的這種錐度連接不太好 大鳳 評論 襯氟離心泵拆卸遇到:襯氟離心泵有沒有其他連接方式?我覺的這種錐度連接不太好
大鳳 評論 襯氟離心泵拆卸遇到:襯氟離心泵有沒有其他連接方式?我覺的這種錐度連接不太好 42756895@qq.com 評論 襯氟自吸泵吸不上水:針對襯氟自吸泵吸不上水,實際上還有很多原因,我們曾經有個
42756895@qq.com 評論 襯氟自吸泵吸不上水:針對襯氟自吸泵吸不上水,實際上還有很多原因,我們曾經有個 2461015062@qq.com 評論 LHC型抗干磨襯氟磁力:我們公司用了很多臺,可以短時間空轉一會,效果很好,值得購
2461015062@qq.com 評論 LHC型抗干磨襯氟磁力:我們公司用了很多臺,可以短時間空轉一會,效果很好,值得購 2461015062@qq.com 評論 淺談襯氟泵和耐酸泵:不錯,對我的選型很有幫助
2461015062@qq.com 評論 淺談襯氟泵和耐酸泵:不錯,對我的選型很有幫助 2461015062@qq.com 評論 襯氟化工泵泵蓋有什:不錯,了解了
2461015062@qq.com 評論 襯氟化工泵泵蓋有什:不錯,了解了 2461015062@qq.com 評論 淺談耐腐蝕塑料泵常:今天終于了解了,感謝綠環泵業,你們做的很好
2461015062@qq.com 評論 淺談耐腐蝕塑料泵常:今天終于了解了,感謝綠環泵業,你們做的很好 2461015062@qq.com 評論 綠環氟塑料化工泵襯:綠環的泵不錯,使用效果很好
2461015062@qq.com 評論 綠環氟塑料化工泵襯:綠環的泵不錯,使用效果很好 王興 評論 最新的一種襯氟自吸:寫的不錯。解決了我的問題。謝謝
王興 評論 最新的一種襯氟自吸:寫的不錯。解決了我的問題。謝謝 36001522@163.com 評論 最新的一種襯氟自吸:有沒有自吸高度7M的襯氟自吸泵?
36001522@163.com 評論 最新的一種襯氟自吸:有沒有自吸高度7M的襯氟自吸泵? 大鳳 評論 鹽酸泵選型有哪些要:文章很不錯,分析的很透徹
大鳳 評論 鹽酸泵選型有哪些要:文章很不錯,分析的很透徹 3254687@126.com 評論 CQB-F型氟塑料磁力泵:我們是南京鈦白化工,我們用過綠環很多磁力泵,質量都非常。
3254687@126.com 評論 CQB-F型氟塑料磁力泵:我們是南京鈦白化工,我們用過綠環很多磁力泵,質量都非常。 老鳳 評論 帶您了解一下什么是:歡迎大家在線交流討論。
老鳳 評論 帶您了解一下什么是:歡迎大家在線交流討論。 老鳳 評論 帶您了解一下什么是:不錯的文章,值得學習一下。
老鳳 評論 帶您了解一下什么是:不錯的文章,值得學習一下。 老鳳 評論 淺談氫氟酸泵的選型:歡迎大家在下面評論交流,我們將一一回復。
老鳳 評論 淺談氫氟酸泵的選型:歡迎大家在下面評論交流,我們將一一回復。 58833797@163.com 評論 襯氟磁力泵的關健技:不錯的文章,值得一看。
58833797@163.com 評論 襯氟磁力泵的關健技:不錯的文章,值得一看。 456677@55.44 評論 LMU耐腐耐磨料漿泵:我們需要20幾臺脫硫泵
456677@55.44 評論 LMU耐腐耐磨料漿泵:我們需要20幾臺脫硫泵 58833797@163.com 評論 LHC型抗干磨襯氟磁力:我想咨詢一下,這種泵是否可以空轉?
58833797@163.com 評論 LHC型抗干磨襯氟磁力:我想咨詢一下,這種泵是否可以空轉? admin 評論 LCB不銹鋼重型磁力泵:CQB不銹鋼磁力泵很不錯,我們用的很好。
admin 評論 LCB不銹鋼重型磁力泵:CQB不銹鋼磁力泵很不錯,我們用的很好。 admin 評論 百斯特電子獲《南方:是嗎??
admin 評論 百斯特電子獲《南方:是嗎?? admin 評論 百斯特電子獲《南方:不錯,很好
admin 評論 百斯特電子獲《南方:不錯,很好 admin 評論 百斯特電子獲《南方:謝謝分享,看看
admin 評論 百斯特電子獲《南方:謝謝分享,看看
還沒有評論,快來搶沙發吧!

Copyright ??南京綠環泵業有限公司 版權所有 蘇ICP備19051842號
服務電話:025-58833797 83556369 58630291 ? 傳真:025-58833706
公司地址:南京市浦口區大橋北路1號 安徽工廠:涇縣經開區新昌路33號






 在線客服
在線客服
